Watchmaker 酶法片段化 DNA 文库制备试剂盒的推荐应用是什么?
该试剂盒旨在将质量可变的 DNA 高效转化为与 Illumina 兼容的测序准备文库,因此支持多种应用,包括:
- 全基因组测序 (WGS)
- 全外显子组测序 (WES)
- 利用杂交捕获进行靶向测序
- 低起始量且具有挑战性的样品,如福尔马林固定石蜡包埋
- 宏基因组分析
- RNA 测序(使用 cDNA 作为起始)
我是否该涡旋酶法片段化、末端修复和加 A(片段/AT)反应?
是。充分涡旋预混液的组分和片段化/加A反应,确保样品之间的片段化结果一致。当制备少量反应时,可以通过移液管混合。
Watchmaker 酶法片段化 DNA 文库制备试剂盒是否与福尔马林固定石蜡包埋 DNA 兼容?
试剂盒与从福尔马林固定石蜡包埋中提取的 DNA 兼容。从福尔马林固定石蜡包埋中提取的 DNA 可能具有不同程度的交联或其他化学修饰,这可能会影响片段长度和/或起始量 DNA 到测序文库的转换效率。确保提取方案针对样品类型进行了优化。在开始制备文库之前,通过 qPCR 评估 DNA 质量可以告知所需应用的起始量质量要求。
为了满足与完整 DNA 相同的片段长度图谱,福尔马林固定石蜡包埋可能需要更短的片段化时间。首先,将片段化时间缩短一半,以获得与完整 DNA 相同的插入物大小。可能需要进一步优化。
随着起始量 DNA 的增加/减少,我应该如何修改酶法片段化条件?
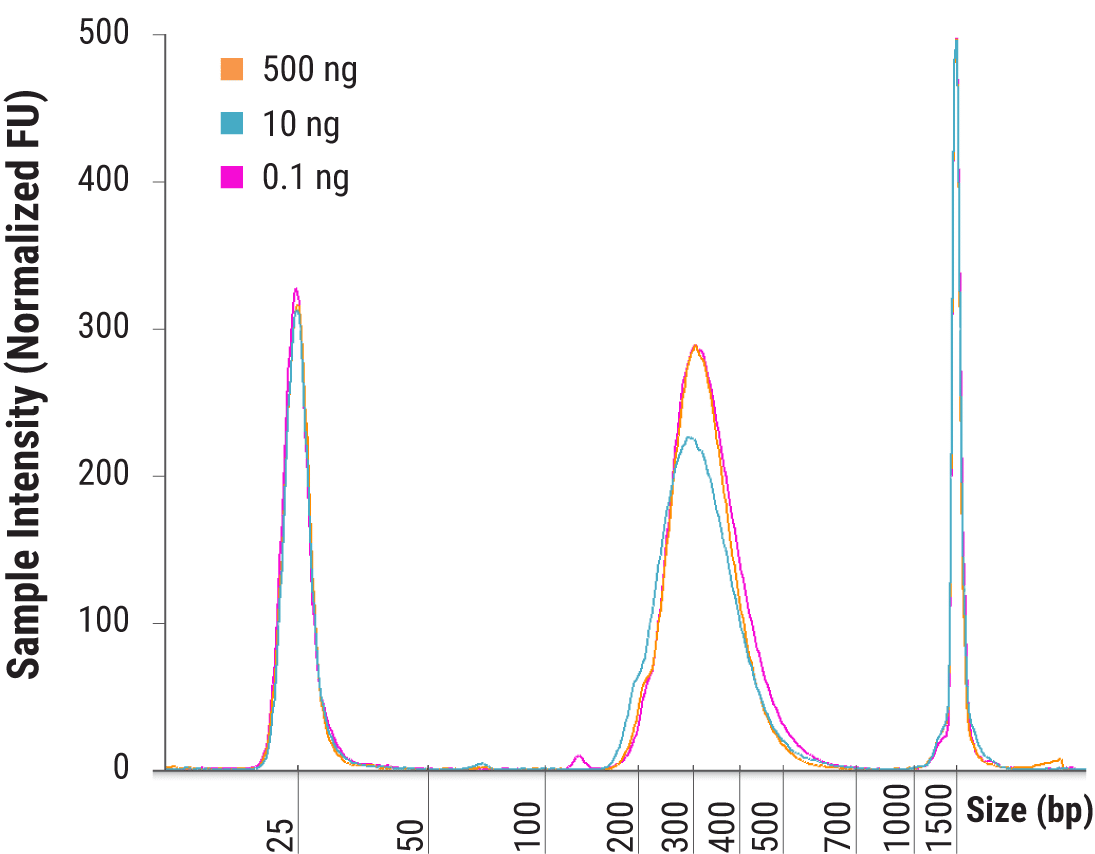
将 500、10 和 0.1 ng 人类基因组 DNA 在 37°C 下片段化 20 分钟,重复构建两个文库。采用 TapeStation(Agilent)D1000 检测评估最终文库大小分布。
如何调整不同起始量的接头浓度?
| DNA 起始量 (ng) | 接头浓度* | 接头:插入物摩尔比 |
|---|---|---|
| 10 – 500 | 15 µM | 最多 1500:1 |
| 1 – 10 | 3 µM | 300 – 3000:1 |
| < 1 | 0.6 µM | > 300:1 |
*基于 300 bp 片段大小估计的接头-插入物比率;超过 50 ng 的起始量将使用相同体积和浓度的接头;对于小于 10 ng 的质量,计算维持接头与插入物 300:1 浓度所需的浓度。
推荐的试剂盒起始量是多少?
该试剂盒在广泛的起始量范围(1 ng – 500 ng)兼容。当使用高质量的 DNA 起始量时,转换效率在此起始范围内很高。
How much input do I need to generate sequenceable concentration of library?
最佳起始量范围将取决于应用。当预期的目标文库浓度为 5 nM 时,我们建议以至少 20 ng –30 ng 作为起点,生成 200 bp 插入物长度的文库(例如,全外显子组测序)。For PCR-free WGS workflows targeting >400 bp inserts lengths, we recommend starting with ~100 ng of input DNA. 产量可能会因进入流程的 DNA 质量差异而有所不同(福尔马林固定石蜡包埋样品需要更多质量的起始量)。
PCR-Free 工作流程是否有什么特殊考虑?
确保使用足够的 DNA 起始量来创建足够的文库,以便在不进行扩增的情况下进行 QC 和测序。100 ng 高质量 DNA 是很好的起点,尽管可以从 50 ng 或更少的 DNA 生成高质量的文库。福尔马林固定石蜡包埋 DNA 可能需要更多的起始量,并且会因样品而异。需要全长接头,因为不可能通过 PCR 将样品条形码或 P5/P7 序列引入文库。
注:鉴于接头的结构,PCR-Free 文库会比实际的在 TapeStation 和 Bioanalyzer 等电泳分析仪上显示的长度更长。
哪些接头与 Watchmaker 酶法片段化 DNA 文库制备试剂盒兼容?
任何带有 3' 悬垂 T 的接头都是兼容的。请注意,接头质量会影响文库的整体制备效率。
以下是 IDT 的一些选项:
- xGen 短型接头和 UDI 引物(目录号 10005976 或 10005921)。这种解决方案包括在连接过程中将一个短型或截短的 Y 型接头连接到文库,然后在文库扩增过程中添加带有 PCR 引物的独特双端索引,以引入样品标签用于多重测序。
- xGen UDI-UMI 接头(目录号 10006914 和 10005903)。这些是全长 Y 形接头(独特的双端样品条形码,带有可选的独特分子标签),可以连接。如果在文库构建中起始量足够,则这些可用于 PCR-Free 的应用。
对于我们目前运行的片段化工作流程,所有样品在开始片段化之前都要经过 3X SPRI 微珠纯化,以确保样品均在 Tris 而非 TE 中洗脱。您是否建议在我们的方案中保持此微珠纯化,以获得最佳片段化效果?
乙二胺四乙酸(EDTA)可能会影响片段化效果,但具体取决于反应中 EDAT 的最终浓度。经验证,在最终 50 ul 反应中可耐受 0.1 mM 的 EDTA。如果 EDTA 在 50 µL 中超过 0.1 mM,建议进行纯化步骤。
我是否可以将 PCR 产物或扩增子与 Watchmaker 酶法片段化 DNA 文库制备试剂盒结合使用?
是,用户指南中建议的片段化时间适用于 gDNA 和 PCR 产物,因此无需进一步优化。同一实验中在相同的片段化条件下,对高质量的人类 gDNA、质粒 DNA(约 5 kb)和 1.1 kb PCR 产物进行片段化,得到了相当的片段长度。
我的片段尺寸比预期的要小。我应该如何处理样品,以使我的片段长度符合用户指南中预期的长度?
根据用户指南中的建议,有两点需要重点关注,以帮助获得最佳的片段长度。目标是确保在放入热循环器后才开始片段化反应。这可通过在制备过程中始终保持所有反应组分处于低温环境来实现。以下是一些建议:
- 使片段化酶和缓冲液在冰中平衡。
- 确保 DNA 样品(40 µL)在冰中预冷。如果用于稀释 DNA 储备液的稀释剂储存在室温下,应特别注意在反应前使样品重新充分冷却。我们发现这些非常有效。
- 向在冰中的 DNA 样品中加入冷冻的酶和缓冲液。
- 在热循环之前混合反应时,快速执行此步骤,以最大程度降低任何潜在的温度升高。将反应保持在冰中,直至直接转移至预冷的热循环器中。确保热循环器上的升温速率设置为默认值(与较慢的升温速率相反)。
对于片段长度的批次效应而言,通常的用户间、批次间、日间的差异是怎样的?
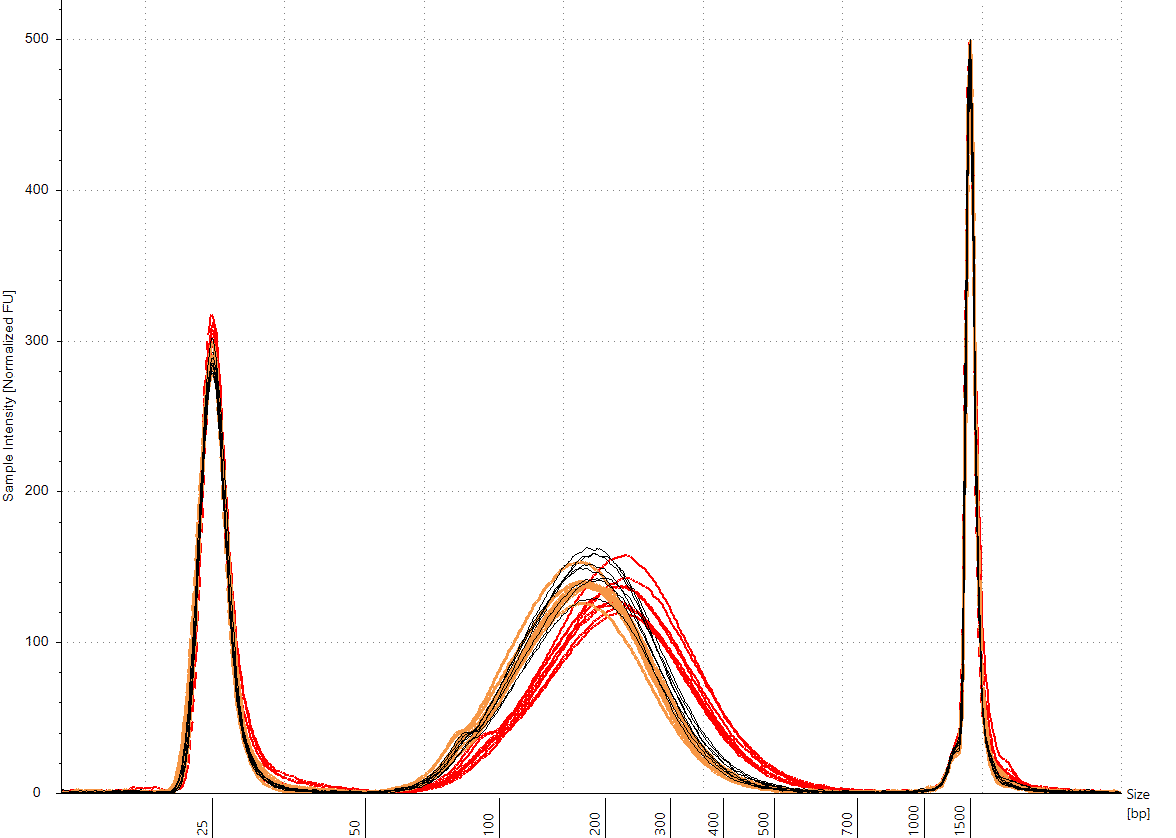
- 技术重复 CV 小于 3%
- 与 200 bp 目标值的偏差为6 – 8%
- 用户间和日间差异小于 4 bp
- 试剂批次间的差异约为 25 – 30 bp(在这两种情况下,与目标值的差异均小于 8%)
Do you offer custom formats?
Yes! Watchmaker offers customer fills, packaging, concentrations, and labeling – including private label – designed to meet your unique needs. We offer flexible terms to serve organizations of any size, and our right-sized processes enable rapid turnaround time on customization. Please contact sales@watchmakergenomics.com to learn more about our capabilities.
Are you ISO 13485-certified?
Yes! Our Quality Management System has achieved ISO 13485:2016 Certification. 我们的证书被授予设计、开发、制造、合同制造和支持在医学研究中的基因组学应用的高性能试剂。Download the certificate here.
